【Cancer Research】中山大学庄诗美团队揭示肿瘤低氧微环境对TGFβ1抗血管生成作用的影响及机制
2024年10月2日,由赌博app-网络赌博软件
庄诗美教授领导的研究团队,在国际癌症权威杂志《Cancer Research》上在线发表了他们的最新研究成果“HIF1α Counteracts TGFβ1-Driven TSP1 Expression in Endothelial Cells to Stimulate Angiogenesis in the Hypoxic Tumor Microenvironment”。

血管生成是肿瘤生长和转移的前提基础。先前的体外模型研究发现转化生长因子β1 (TGFβ1)可能抑制血管生成,而肿瘤微环境中高丰度的TGFβ1与活跃的血管生成并存,这一矛盾现象背后的机制尚未知。
在该研究中,科研人员利用斑马鱼模型和鸡胚绒毛尿囊膜,发现TGFβ1能抑制生理性的血管生成;然而,在小鼠肝癌移植瘤模型中,TGFβ1并不能抑制血管生成。通过分析肿瘤内皮细胞(TEC)和癌旁内皮细胞(NEC)的转录组数据,发现TGFβ1信号通路分子的表达在TEC中降低,并且低氧诱导因子HIF1α通路与TGFβ信号分子的表达呈现负相关,提示低氧可能影响TGFβ1通路。进一步的体内实验结果显示,HIF1α抑制剂能恢复小鼠肿瘤中TGFβ1对血管生成的抑制作用;HIF1α稳定剂则削弱斑马鱼中TGFβ1对血管生成的抑制作用。体外实验结果显示,TGFβ1可抑制内皮细胞的迁移和管形成,该作用会被低氧阻断。
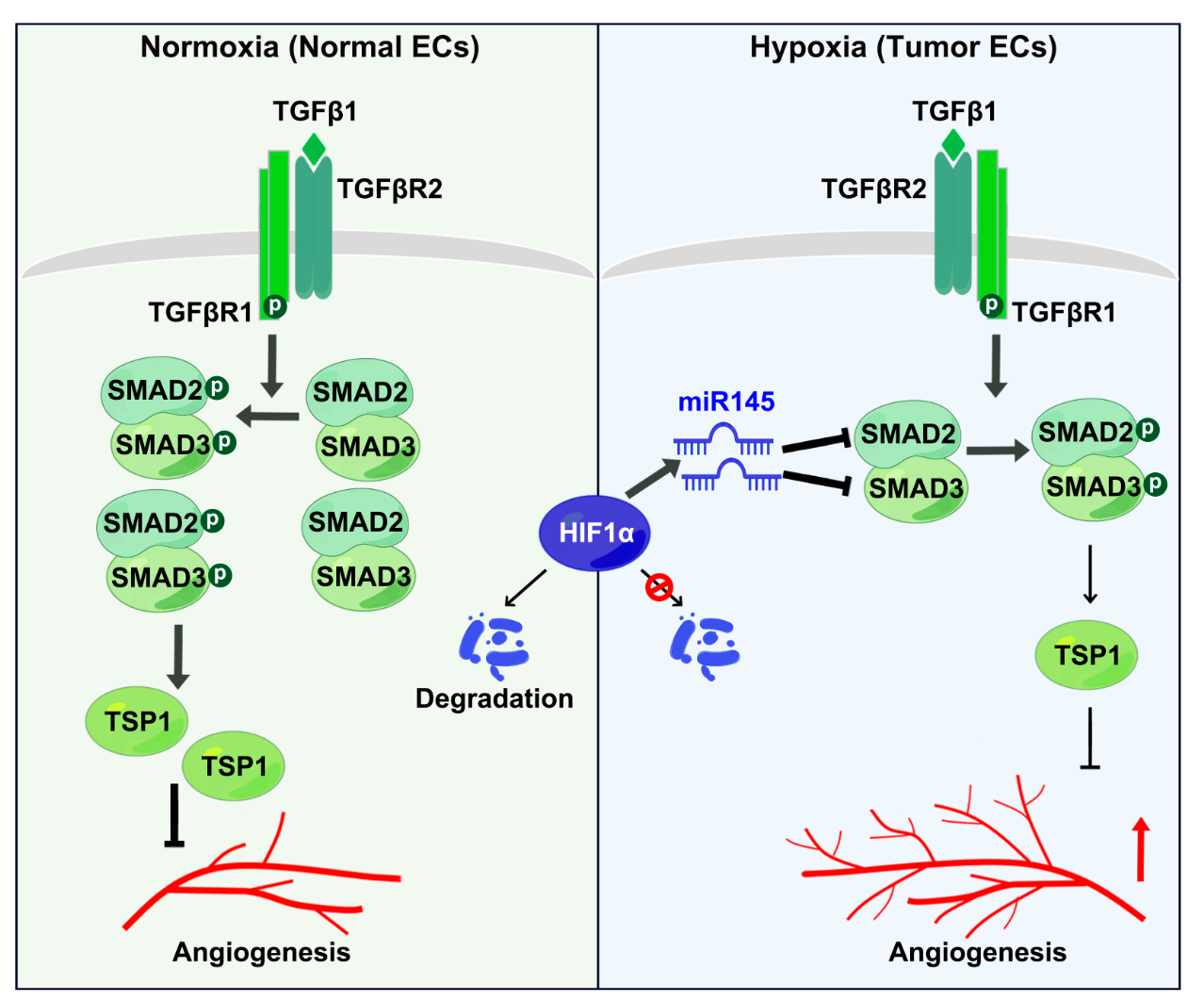
进一步的机制研究显示,正常的生理条件下TGFβ1通过激活内皮细胞中的TGFβR1-SMAD2/3信号通路,上调血管生成抑制因子TSP1的转录表达,进而抑制血管生成。然而,在肿瘤微环境中,低氧诱导因子1α(HIF1α)上调,继而诱导miR145的转录,miR145通过结合SMAD2/3的mRNA,抑制SMAD2/3的表达,阻断TGFβ1对TSP1的上调作用,最终阻断TGFβ1的抑血管生成功能。
最后,科研人员利用临床样本进行验证,发现与来自邻近非肿瘤肝脏的NEC相比,人肝癌组织中分离的TEC中miR145水平升高,SMAD3和TSP1水平下降。而且,人肝癌患者TEC中SMAD3、TSP1表达与血管面积呈现负相关,这些结果进一步证明了在TEC中SMAD3-TSP1轴的失活。
综上所述,该研究揭示了在常氧条件下,内皮细胞中的TGFβ1 -SMAD2/3-TSP1信号抑制血管生成;在肿瘤低氧微环境中,HIF1α-miR145轴能抵抗TGFβ1的抗血管生成作用。这些发现揭示了肿瘤血管生成调控的新机制,为癌症治疗提供了新的理论依据和潜在靶点。
赌博app-网络赌博软件
庄诗美教授和方坚鸿教授作为论文的共同通讯作者。赌博app-网络赌博软件
博士毕业生罗雨薇博士为论文的第一作者。本文受到国家重点研发计划、国家自然科学基金、广东省基础与应用基础研究基金项目资助。
论文链接:
//aacrjournals.org/cancerres/article-abstract/doi/10.1158/0008-5472.CAN-24-2324/748779/HIF1-Counteracts-TGF-1-Driven-TSP1-Expression-in?redirectedFrom=fulltext



