赌博app 崔隽教授课题组揭示棕榈酰化调控抗病毒关键适配体蛋白MAVS激活的新机制
线粒体抗病毒适配体蛋白MAVS在RNA病毒诱导的固有免疫反应中扮演着至关重要的“开关”角色。作为免疫反应中的核心分子,MAVS通过接收来自细胞质RNA传感器RIG-I的上游信号,形成类朊病毒聚集体,并启动强烈的免疫反应,旨在清除入侵的病原体。与此同时,MAVS的激活和抑制需要严格调控,确保免疫反应既能有效应对病毒感染,又不会导致过度的免疫反应以及自身免疫疾病的发生。因此,MAVS的功能必须受到精准调控,以维持免疫稳态。
大量研究表明,K63泛素化修饰对于MAVS的功能和活化发挥决定性作用,多种其他类型的蛋白翻译后修饰(如精氨酸单甲基化、O-糖基化和SUMO化等)都是通过影响MAVS的泛素化水平(如K48或K63泛素化),从而调节MAVS的稳定性、活性以及信号传递的强度和持续性。
近期的多项研究开创性地揭示了蛋白质的脂类修饰也参与了MAVS的活化调控,多种棕榈酰基转移酶(如ZDHHC4、ZDHHC7或ZDHHC24)被发现能够介导MAVS的棕榈酰化修饰,从而增强宿主的抗肿瘤和抗病毒免疫反应。但是目前棕榈酰化修饰和泛素化修饰对于MAVS的调控时序和互作机制尚未明确。
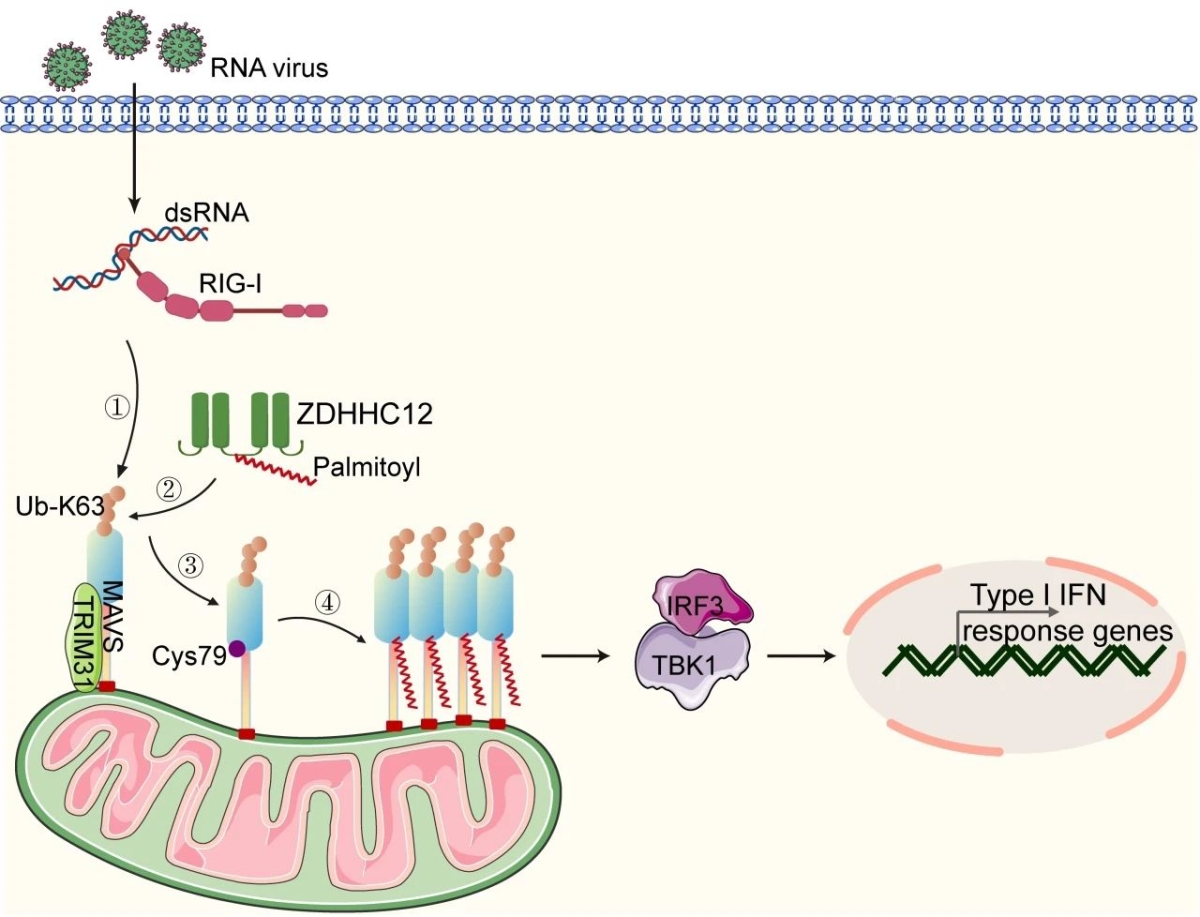
图1 ZDHHC12介导MAVS棕榈酰化修饰,促进抗病毒免疫反应的工作模型
近日,赌博app
崔隽教授课题组在Journal of Clinical Investigation杂志上发表题为“Palmitoylation acts as a checkpoint for MAVS aggravation to promote antiviral innate immune responses”的研究论文,该研究揭示了棕榈酰基转移酶ZDHHC12介导的MAVS棕榈酰化修饰,是MAVS发生寡聚化,从而激活抗病毒固有免疫信号通路的必要步骤。
研究人员发现在RNA病毒感染的巨噬细胞中,ZDHHC12介导的MAVS棕榈酰化修饰并不会影响MAVS的稳定性或其线粒体定位,也不会影响导致MAVS激活的K63泛素化修饰水平。但是当ZDHHC12缺陷时,尽管MAVS仍然能够发生充分的泛素化,但是其棕榈酰化的丧失会导致其无法被进一步活化并发生寡聚化。
反之,MAVS的泛素化修饰能够影响ZDHHC12的募集及其介导的MAVS棕榈酰化水平。因此,ZDHHC12介导的棕榈酰化修饰发生在其泛素化修饰的下游,是MAVS激活过程中的“最后关键一步”。研究人员还发现MAVS棕榈酰化失调和系统性红斑狼疮的发生存在相关性。这一发现为我们理解脂质代谢在免疫信号网络中的调控作用提供了新的视角,也为未来开发靶向自身免疫性疾病的治疗策略提供了潜在的分子靶点。
赌博app-网络赌博软件
与附属第六医院生物医学融合创新中心的王丽邱副教授为论文第一作者,崔隽教授为通讯作者。该研究得到国家自然科学基金等项目支持。
论文链接://www.jci.org/articles/view/177924



